誰でも分かる技術
誰でも分かる鋳物基礎講座
銅合金鋳物の材質と基礎知識
3-1 「銅合金鋳物とは」
1. 2 合金の基礎と凝固過程
JISで規定されている合金種類は現在9種類あります(前回表1参照)。これらの合金は基本的には、Cu-Sn系、Cu-Zn系、Cu-Al系ならびにCu系に分類されます。それぞれ青銅系、黄銅系、アルミニウム青銅系、純銅系と呼ばれています。 JISには規定されておりませんが、高熱伝導合金として高温強さを高めたCu-Cr系やCu-Zr系あるいはCu-Cr-Zr系、また独特の性質を有するCu-Be系合金も鋳物として広く使われております。それぞれの合金は、呼称される合金系の元素を主要元素として、さらに幾多の元素を添加して実用合金として使われているわけです。
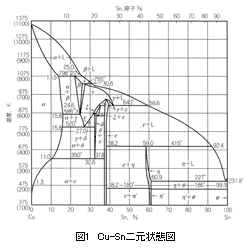
銅合金の凝固過程を考えていきましょう。そのために先ず基本合金に立ち戻ります。銅合金鋳物の太宗であるCu-Sn、Cu-Zn、Cu-Al二元状態図を示します。
 |
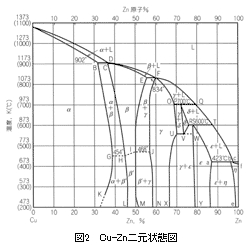 |
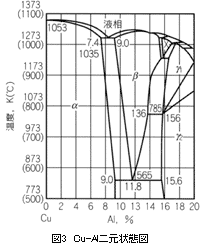
これら3つの状態図から、銅側においてCu-SnならびにCu-Zn系は包晶、Cu-Al系は共晶を示す合金であることがわかります。凝固温度範囲は、Cu-Zn、Cu-Al系は狭く、Cu-Sn系は広いことを示しております。また、Cu-Al合金では、β相は共析変態します。
以上のような平衡状態を示す状態図から、銅合金鋳物の凝固過程、凝固中の引け巣発生、凝固組織の様相がおおよそは予想され、各合金毎の特徴ある凝固挙動、鋳造欠陥発生機構、凝固組織の形成などが理解されます。例えば、青銅系合金では凝固温度範囲が広いので、マッシー(かゆ状)凝固を示す代
表的な合金で、砂型鋳造では鋳物肉厚全面に亘り、固体と液体が共存する状態が長く続きます。すなわち、鋳物表面から固体・固液共存・液体と区別できることはほとんどないと言えます。換言致しますと、鋳物表面近傍で凝固が完了した凝固層が存在するのは、中心部もかなり凝固が進んでいる、状況です。このような場合、凝固収縮を補填する押湯からの溶湯補給は完全には期待できず、微細分散引け巣が発生します。
また、溶湯のみの補給による引け巣防止効果は期待できず、固体と液体両者が移動して補給するマスフィーディング(質量補給)が重要となります。一方、黄銅系やアルミニウム青銅では。凝固範囲が狭く、表皮形成型の凝固を致します。引けは集中し易く中心線引け巣も生じます。したがって引け巣対策は青銅系と黄銅・アルミニウム青銅系とでは異なって参ります。
さて上記な凝固過程はマクロ的なスケールの進行を定性的に、状態図との関連で述べたものです。定量的には、当該の鋳物に対し、コンピュータによる凝固解析で凝固の進行を把握することができます。これらはまた別の章で述べたいと思います。鋳物の性質と密接に関係する組織の発達過程を見るためには、凝固過程をミクロ的に定量的に記述する必要があります。
青銅系合金の場合、錫量が固溶限(二元系の場合13.5%)以下、例えば4%であっても、δ相が認められます(写真 5参照)。昔は非平衡な凝固においては、固相線が低濃度側にシフトし、例えば3.5%Snが最大固溶限になるように固相線がシフトする、と考えられたこともありました。そうすると4%錫合金でも、包晶反応によってβ相が晶出し、このβ相が共析変態によってδ相が生じると解釈しておりました。現在では凝固理論も発展整備され、このような固相線のシフトが起こるのは超急冷凝固に限られ、砂型のような凝固速度では、固相線シフトは起こりません。そして固液界面は局所平衡状態にあると言われております。これは、固液界面では界面温度・液相界面濃度・固相界面濃度の関係は平衡状態にあることを意味し、一つが規定されれば、他の二つは状態図によって決められることを意味致します。またこれは凝固界面において、液相ならびに固相の溶質元素の配置が速やかに進行し平衡と見なされる、ことを意味しております。すなわち、凝固における液体・固体界面(固液界面)においてはその箇所は平衡と見なしているわけです(局所平衡と呼称される)。固液界面は平衡と見なされても、凝固全体の反応は当然非平衡です。この点を、液体と固体において溶質元素の拡散から見直してみます。
銅合金においては、溶質元素は銅の格子に置換して配置し、固溶しております(置換型)。気体元素である水素・酸素原子は銅の格子に侵入して配置しております(侵入型)。侵入型は、直感的にわかるように、侵入原子は拡散しやすいのですが、置換型元素は、たとえ固相線直下の高温でも、拡散は遅い。典型的には固相線直下で拡散係数は10-12 m2/s以下です。ところで液体中の同じ元素の拡散係数は10-9 m2/sのオーダです。このように液体と固体(固相線直下)とでは普通は3桁から4桁違います。拡散係数の大きさは、大きいほど拡散によって元素が動きやすいことを意味し、液体の動きと比べ固体ではほとんど動かないことを意味しております。固体の温度が下げれば拡散係数はさらに大きく下がり、凝固のような短時間ではとても溶質元素は固体中を移動する(拡散する)ことはできません。すなわち、固体中においては、溶質元素は一つの極限として何も動かない(拡散しない)と仮定することは現実によく適合している仮定になります。
溶質元素は固体では拡散しなくて、固液界面では局所平衡とすると、先程述べたように、凝固した界面(固体界面)では状態図に従う濃度であり、一端固まった場所の濃度は、変化しないことを意味します。つまり、凝固した後は、凝固の状態の濃度を引き続き保っています。
もう一つ、液体状態では溶質元素は完全に混合していると言う仮定を設けると(この仮定もデンドライト凝固の場合、デンドライト間隙においてはよく成立致します。つまり実用上有効な仮定です)、有名なシャイルの式(最近ではガリバー・シャイルの式と呼ぶことが多い)が成立致します。この式は、上に述べたよう仮定を含んでいますが、実用上許容される仮定であり、定量的に簡単に計算できるところから極めて実用性に富んだ式(1)となっています。
固相線シフトの問題に帰ると、凝固中界面濃度は平衡状態図で決められる濃度であるが、凝固後の固体中の濃度は固まった時の濃度のまま変化せず、その分液相中には溶質濃度は濃化していきます。固体界面濃度が初期濃度C0になっても(合金の固相線温度に凝固が進行しても)、液相は残存し(平衡凝固の場合は、この温度で凝固が終了)、溶質濃度は濃化を続けます。図4からその様相をご理解下さい。
青銅鋳物6種(CAC406)においては、錫量は5%ですが、固体の界面濃度が5%になっても凝固は完了せず、以後も凝固中液相中の濃度は濃化を続け、包晶濃度25%に達しさらにβ相、γ相を晶出し、凝固が完了し、室温ではδ相が観察される、ことになります。また、黄銅・アルミニウム青銅においても、実用上重要な亜包晶ならびに包晶反応が関与する組成合金でも、β相を晶出しながら凝固が完了して参ります。β相からα相が変態析出し、凝固組織は室温では観察するのが難しくなります。また、アルミニウム青銅では共析変態に伴う組織が観察されます。 凝固率fsと固相界面濃度Csの関係は以下の通りです。
ここでkは平衡分配係数。
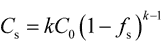 (1)
(1)
凝固率fsと界面温度Tとの関係は以下の通りです。
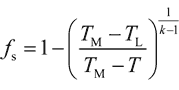 (2)
(2)
ここで、TMは銅の融点。TLは初期濃度C0に対応する液相線温度。
次回は実用合金と最近話題の鉛フリー銅合金について述べます。
